Sr3[Co(CN)3] und Ba3[Co(CN)3]: „Einfache“ Verbindungen mit weitreichenden Auswirkungen auf die Chemie stark reduzierter Metallate
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Chemische Physik fester Stoffe
Prolog
Die immer ausgeprägtere Unterteilung von Fachgebieten der Naturwissenschaften, z. B. der Chemie, hat im vergangenen Jahrhundert zu einer Aufspaltung in kleinere Bereiche geführt, die sich getrennt voneinander entwickelten. In der Anorganischen Chemie haben sich neben anderen Bereichen etwa die Festkörperchemie und die Koordinationschemie etabliert. Festkörperchemiker sind als eher "brutal" bekannt, da sie mit hohen Temperaturen und zum Teil auch hohen Drücken versuchen, Feststoffgemische zur Verbindungsbildung zu zwingen. Die Koordinationschemiker sind dagegen "feine Leute", die mit Lösungsmitteln bei niedrigeren Temperaturen arbeiten und sich sogar Gedanken über die ablaufenden Reaktionsmechanismen machen (können).
Diese Aufteilung in kleine Fachgebiete ist natürlich reine Willkür, da allen Beteiligten nur das eine Periodensystem der Elemente zur Verfügung steht, welches die Eigenschaften von Reaktionskomponenten bestimmt, egal ob Festkörper- oder Koordinationschemie. Die aktuelle Notwendigkeit zu Veränderungen ist damit klar definiert: Zusammenfügen, was zusammengehört! Das ist zweifellos kein einfaches Unterfangen, und es gelingt auch lediglich mit wechselndem Erfolg.
Hier kann nun über ein gelungenes Beispiel berichtet werden, bei dem eine experimentelle Arbeit aus dem Bereich der Festkörperchemie, gestützt durch ausgefeilte spektroskopische Methoden der Festkörperphysik und durch quantenchemische Rechnungen zur Chemischen Bindung zu Ergebnissen geführt hat, deren Bedeutung für die Koordinationschemie unmittelbar erkannt und auch herausgestellt wurde. Dieser Zusammenhang soll auf der Basis der Originalarbeit [1] und der nachfolgend erschienenen Würdigung [2] dargelegt werden. Beide Arbeiten [1,2] enthalten alle wissenschaftlichen Details mit entsprechenden Zitaten. Der vorliegende Beitrag ist vergleichsweise kurz gehalten und soll möglichst allgemeinverständlich erkennen lassen, wie es zu den Arbeiten kam, und welche Konsequenzen sich daraus ergeben.
Forschungsstrategie und erster Ergebnisse
Chemische Reaktionen von Übergangselementen enthaltenden Metallgemischen mit Sauerstoff, Stickstoff oder Kohlenstoff führen zu Verbindungen (Oxo, Nitrido- oder Carbometallate), in dem die (positiven) Oxidationsstufen der Übergangmetalle in der genannten Reihenfolge immer niedriger werden. Diese Beobachtung führte zu Experimenten, bei denen die Metallgemische mit Stickstoff in Gegenwart von Kohlenstoff umgesetzt werden sollten. Ohne Kohlenstoff bildet sich z. B. die Verbindung Sr[NiN], die Nickel in der Oxidationsstufe +1 enthält; bei gleichzeitiger Gegenwart von Kohlenstoff wird Sr2[NNi(CN)] mit Nickel in der Oxidationsstufe 0 gebildet. Die Oxidationsstufen für das Übergangselement Nickel ergeben sich aus gängigen Valenzregeln mit den Ladungszuordnungen Sr2+, N3– und (CN)– sowie aus der Einhaltung der Elektroneutralität. Die in eckigen Klammern enthaltenden Teile der Formeln kennzeichnen komplexe Anionen (durch kovalente Bindungen zusammengehalten), die im Falle von [NiN]2– als Nitridonickelat (I), und im Falle von [NNi(CN)]4– als Nitridocyanonickelat (0) bezeichnet werden. Der Cyanoligand beweist auch hier die von ihm bekannte "Unschuld", was bedeutet, dass er in allen bisher bekannten Verbindungen ausschließlich einfach negativ geladen auftritt und nicht weiter reduziert werden kann.
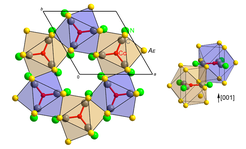
Nach Optimierung der Synthesebedingungen waren auch mit dem Übergangsmetall Cobalt Cyanoverbindungen durch Hochtemperatursynthese zugänglich. Kristallstrukturbestimmungen und chemische Analysen führten übereinstimmend zu den chemischen Formeln Sr3[Co(CN)3] und Ba3[Co(CN)3]. Die Kristallstruktur (Abb. 1) der isotypen Verbindungen zeigte sich eng verwandt mit den bekannten Nitrodometallaten AE3[MN3] (AE= Sr, Ba; M = Cr, Mn, Fe), bis auf den Unterschied, dass die einatomigen Nitridoliganden durch zweiatomige Cyanogruppen ersetzt waren. Im Prinzip gab es also keine größeren Überraschungen, bis auf die Tatsache, dass unter der Annahme eines "unschuldigen" Cyano-Liganden dem zentralen Cobaltatom eine extrem hohe negative Ladung zugeordnet werden musste: z.B. Sr2+3[Co3–(CN)–3]. Solche hohen negativen Ladungen auf Übergangsmetallen waren lediglich von den nur bei niedrigen Temperaturen stabilen Carbonylverbindungen mit dem als neutral angesehenen CO-Liganden bekannt: z. B. Na+3[Co3–(CO)3]. Jetzt wurde es interessant.
Lösung des Problems
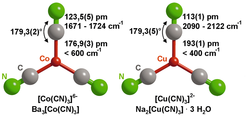
Schnell war klar, dass das Augenmerk der Folgeuntersuchungen auf die genaue Analyse der CN-Liganden und den Valenzzustand des Cobalts ausgerichtet sein musste. Die Kristallstrukturanalyse hatte als Besonderheit bereits ergeben, dass die C–N-Bindung im zweiatomigen Liganden mit 124 pm ungewöhnlich lang ist. „Unschuldige“ Cyano-Liganden (|C≡N|–) weisen eine recht homogene Verteilung der C–N-Bindungslängen zwischen 113 pm und 116 pm auf. Entsprechend liegen die C–N-Streckschwingungsbanden in den IR- und Raman-Spektren im Falle des „unschuldigen“ Cyano-Liganden bei deutlich erhöhten Frequenzen. Abbildung 2 zeigt diese Verhältnisse für Ba3[Co(CN)3] und Na2[Cu(CN)3]·3H2O (ein Cyanocuprat (I)).
Nachdem auch die quantenchemischen Rechnungen an Ba3[Co(CN)3] für die CN-Liganden ergeben hatten, dass die verlängerte Bindung mit der Besetzung von sogenannten antibindenden Orbitalen einhergeht, und dass die Liganden eine deutlich höhere Ladung tragen ((CN)1,67–), war klar, dass die CN-Gruppe ihre „Unschuld“ verloren hatte. Da durch geeignete spektroskopische Methoden gleichzeitig festgestellt worden war, dass die Barium- bzw. Strontiumionen sicher zweifach positiv geladen sind, und keine Anzeichen für ungepaarte Elektronen (Radikale) in den Verbindungen zu finden waren, musste der Schlüssel zur Lösung des Problems im Valenzzustand des Cobalts liegen.
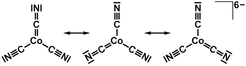
Aus röntgen-photoelektronen-mikroskopischen Daten wurde für Cobalt eine geschlossenschalige d10-Konfiguration abgeleitet, die mit den berechneten Zustandsdichten für Ba3[Co(CN)3] übereinstimmt. Damit war für Cobalt die Oxidationsstufe 1– nahegelegt. Als ionische Grenzformel für die beiden isotypen Verbindungen (EA = Ba, Sr) resultiert dann: EA2+3[Co1–(CN)1,67–3]. Zur Vermeidung gebrochener Ladungszahlen eignet sich das Bild mesomerer Grenzstrukturen, in denen neben zwei Cyano-Liganden (|C≡N|)– eine Percyanogruppe (C=C)3– (diese ist isoelektronisch mit dem O2-Molekül) vorliegt. Das komplexe Anion ist damit als Monopercyanodicyanocobaltat (–I) zu beschreiben (Abb. 3).
Vorläufiges Konzept und mögliche Auswirkungen
Beginnen wir die Überlegungen mit der festgestellten d10-Konfiguration des Cobalts. Dann ist hinlänglich bekannt, dass halb (d5) oder vollständig (d10) gefüllte d-Schalen besonders stabile Zustände repräsentieren. Für [Co(CN)3]6– ist die Situation belegt. Im Falle des eingangs erwähnten Nitridocyanometallats(0), Sr2[NNi(CN)], ist für Nickel ebenfalls eine d10-Konfiguration anzunehmen. Spielt man diesen Gedanken konsequent weiter, so sind d10-Konfigurationen in der Reihe der Übergangsmetalle vom Nickel bis etwa zum Mangan wie folgt zu realisieren: Ni0, Co–, Fe2–, Mn3–. Man könnte sogar chemische Formeln auf dem Papier konstruieren, in denen die CN-Liganden mehr und mehr als Percyanogruppen vorliegen, um damit die Elektroneutralität zu wahren und die Zahl der Kationen (möglicherweise wiederum die Erdalkalimetalle) nicht zu groß werden zu lassen. Das ist jetzt allerdings reine Spekulation. Hier müssen künftige Arbeiten abgewartet werden.
Ein zweiter Aspekt betrifft die Gruppe der stark reduzierten Carbonylmetallate, wie z. B. die oben bereits genannte Verbindung Na3[Co(CO)3]. Es ist bekannt, dass der CO-Ligand keineswegs „unschuldig“ ist, sondern eine deutliche Variation in den C–O-Bindungslängen aufweist. Mit welchem Recht wird er bevorzugt als Neutralligand bezeichnet? Warum sollte nicht auch eine Tendenz zur Bildung von Percarbonylgruppen (CO)2– zu berücksichtigen sein? Könnte in der Gruppe der Carbonlymetallate nicht ebenfalls das d10-Konzept für die Übergangsmetalle gelten? Auch hier bedarf es neuer Untersuchungen.
Zurück zum CN-Liganden. Wolfgang Kaim schreibt am Ende seines Berichts [2]: „In Hinblick auf die Neigung des Cyanids, als Brückenligand zu agieren (wie im Berliner Blau) wie auch weitere Koordinationsformen zu bilden, eröffnet das nun belegte Potenzial für sein nicht-unschuldiges Verhalten eine zusätzliche, eine Elektronentransfer-Dimension, und damit vielversprechende faszinierende Entwicklungen für das 4. Jahrhundert der Cyanometallatchemie.“


